Estudio de las mejores condiciones para determinar plaguicidas en aguas y sedimentos del Río Cauca-Colombia
Study of the best conditions to determine pesticides in waters and sediments of the Cauca-Colombia River Condiciones para determinar plaguicidas en aguas y sedimentos
Barra lateral del artículo
Términos de la licencia (VER)

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Declaración del copyright
Los autores ceden en exclusiva a la Universidad EIA, con facultad de cesión a terceros, todos los derechos de explotación que deriven de los trabajos que sean aceptados para su publicación en la Revista EIA, así como en cualquier producto derivados de la misma y, en particular, los de reproducción, distribución, comunicación pública (incluida la puesta a disposición interactiva) y transformación (incluidas la adaptación, la modificación y, en su caso, la traducción), para todas las modalidades de explotación (a título enunciativo y no limitativo: en formato papel, electrónico, on-line, soporte informático o audiovisual, así como en cualquier otro formato, incluso con finalidad promocional o publicitaria y/o para la realización de productos derivados), para un ámbito territorial mundial y para toda la duración legal de los derechos prevista en el vigente texto difundido de la Ley de Propiedad Intelectual. Esta cesión la realizarán los autores sin derecho a ningún tipo de remuneración o indemnización.
La autorización conferida a la Revista EIA estará vigente a partir de la fecha en que se incluye en el volumen y número respectivo en el Sistema Open Journal Systems de la Revista EIA, así como en las diferentes bases e índices de datos en que se encuentra indexada la publicación.
Todos los contenidos de la Revista EIA, están publicados bajo la Licencia Creative Commons Atribución-NoComercial-NoDerivativa 4.0 Internacional
Licencia
![]()
Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-NoDerivativa 4.0 Internacional
Contenido principal del artículo
Resumen
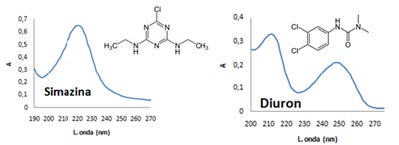
Las diferentes actividades agrícolas, industriales y económicas generan residuos de plaguicidas que van llegando a los diferentes cuerpos de agua, contaminando lagos, ríos, suelos, biota, entre otros. Para realizar el seguimiento de este tipo de sustancias en el medioambiente es necesario ajustar de la mejor forma el procedimiento de análisis. Este trabajo permitió establecer las mejores condiciones de extracción y determinación de los plaguicidas simazina, atrazina, diuron, carbaril, propanil y metomil en aguas y sedimentos de río. Se emplearon los métodos de extracción en fase sólida (SPE) y ultrasonido para la extracción de plaguicidas presentes en aguas y sedimentos respectivamente. La determinación de los compuestos se realizó por cromatografía líquida de alta resolución (HPLC-UV). El método fue probado en muestras de agua y sedimentos del río Cauca en su paso por el Departamento del Valle del Cauca-Colombia-Sur América. Se obtuvieron porcentajes de recuperación por encima del 87% para cinco de los seis plaguicidas extraídos por SPE y por encima del 80% para todos los plaguicidas extraídos por ultrasonido. Los plaguicidas de mayor frecuencia encontrados en aguas y sedimentos del río Cauca fueron simazina, atrazina y diuron.
Descargas
Detalles del artículo
Referencias (VER)
Amparán-Salido, R.T.; López Téllez, J.; Navarro Rodríguez, M. (2003). Metodologías para el estudio del impacto de contaminantes plaguicidas. RETEL revista de toxicológica en línea. pp. 15-18.
Babic, S.; Petrovic, M.; Kastelan-Macan, M. (1998). Ultrasonic solvent extraction of pesticides from soil. Journal of Chromatography A, 823(1-2), pp. 3– 9. https://doi.org/10.1016/S0021-9673(98)00301-X
Biswas, A.K.; Kondaiah, N.; Anjaneyulu, A.S.R.; Rao, G.S.; Singh, R.P. (2010). A simple assay for analyzing residues of carbaryl insecticide in buffalo meat by liquid chromatography–photodiode array detection. Analytical Methods, 2(4), pp. 393-396. https://doi.org/10.1039/B9AY00301K
Carazo-Rojas, E.; Pérez-Rojas, G.; Pérez-Villanueva, M.; Chinchilla-Soto, C.; Chin-Pampillo, J.S.; Mora, P.; Alpízar-Marín, M.; Masís-Mora, M.; Rodríguez-Rodríguez, C.E.; Vryzas, Z. (2018). Pesticide monitoring and ecotoxicological risk assessment in surface water bodies and sediments of a tropical agro-ecosystem. Environmental Pollution, 241, pp. 800-809. https://doi.org/10.1016/j.envpol.2018.06.020
Durak, B.Y.; Chormey, D.S.; Firat, M.; Bakirdere, S. (2020). Validation of ultrasonic-assisted switchable solvent liquid phase microextraction for trace determination of hormones and organochlorine pesticides by GC–MS and combination with QuEChERS. Food Chemistry, 305. https://doi.org/10.1016/j.foodchem.2019.125487.
IUPAC. (1995). Nomenclature in Evaluation of Analytical Methods including Detection and Quantificaction Capabilities. Pure and Applied Chemistry, 67, 1699-1723.
Cui, S.; Hough, R.; Yates, K.; Osprey, M.; Kerr, C.; Cooper, P.; Coull, M.; Zhang, Z. (2020). Effects of season and sediment-water exchange processes on the partitioning of pesticides in the catchment environment: Implications for pesticides monitoring. Science of The Total Environment, 698. https://doi.org/10.1016/j.scitotenv.2019.134228.
Harshit, D.; Charmy, K.; Nrupesh, P. (2017). Organophosphorus pesticides determination by novel HPLC and spectrophotometric method. Food Chemistry, 230, pp. 448-453. https://doi.org/10.1016/j.foodchem.2017.03.083
Nasiri, M.; Ahmadzadeh, H.; Amiri, A. (2020). Sample preparation and extraction methods for pesticides in aquatic environments: A review. TrAC Trends in Analytical Chemistry, 123. https://doi.org/10.1016/j.trac.2019.115772
Masís, F.; Valdez, J.; Coto, T.; León, S. (2008). Residuos de agroquímicos en sedimentos de ríos, Poás, Costa Rica. Nota Técnica Agronomía Costarricense, 32(1), pp. 113-123.
Kumar, S.; Kaushik, G.; Dar, M.A.; Nimesh, S.; López-Chuken, U.J.; Villarreal-Chiu, J.F. (2018). Microbial Degradation of Organophosphate Pesticides: A Review. Pedosphere, 28(2), pp. 190-208. https://doi.org/10.1016/S1002-0160(18)60017-7.
Nivia, E. (2000). Mujeres y plaguicidas, una mirada a la situación actual, tendencias y riesgos de los plaguicidas, estudio de caso en Palmira, Colombia, RAPALMIRA.
Villamizar, M.L.; Brown, C.D. (2016). Modelling triazines in the valley of the River Cauca, Colombia, using the annualized agricultural non-point source pollution model. Agric. Water Manag. 177, pp. 24-36. https://doi.org/10.1016/j.agwat.2016.06.010.
Pellicer-Castell, E.; Belenguer-Sapiña, C.; Amorós, P.; El Haskouri, J.; Herrero-Martínez, J.M.; Mauri-Aucejo, A.R. (2022). Mesoporous silica sorbent with gold nanoparticles for solid-phase extraction of organochlorine pesticides in water samples. Journal of Chromatography A. 1662. https://doi.org/10.1016/j.chroma.2021.462729.
Petrie, B.; Camacho-Muñoz, D. (2021). Environmentally friendly analytical method to assess enantioselective behaviour of pharmaceuticals and pesticides in river waters. Sustainable Chemistry and Pharmacy, 24. https://doi.org/10.1016/j.scp.2021.100558.
Pichon, V.; Coumes, C.C.D.; Chen, L.; Guenu, S.; Hennion, M.C. (1996). Simple removal of humic and fulvic acid interferences using polymeric sorbents for the simultaneous solid-phase extraction of polar acidic, neutral and basic pesticides. Chromatography A. 737, 25-33. https://doi.org/10.1016/0021-9673(95)01339-3
RAS. (2000). Sistemas de potabilización. Reglamento Técnico del Sector de Agua Potable y Saneamiento Básico [Online]. Disponible en: https://procurement-notices.undp.org/view_file.cfm?doc_id=16483. Consultado: 22 febrero 2022.
Rajput, S.; Kumari, A.; Arora, S.; Kaur, R. (2018). Multi-residue pesticides analysis in water samples using reverse phase high performance liquid chromatography (RP-HPLC). MethodsX. 5, pp. 744-751. https://doi.org/10.1016/j.mex.2018.07.005.
Ruberu, S.R.; Draper, W.M.; Perera, S.K. (2000). Multiresidue HPLC methods for phenyl urea herbicides in water. J. Agric. Food Chem. 48. https://doi.org/10.1021/jf000266p
Sarria-Villa, R.; Ocampo-Duque, W.; Páez, M.; Schuhmacher, M. (2016). Presence of PAHs in water and sediments of the Colombian Cauca River during heavy rain episodes, and implications for risk assessment. Science of the Total Environment, 540, pp. 455 – 465. https://doi.org/10.1016/j.scitotenv.2015.07.020.
Tao, S.; Guo, L.; Wang, X.; Liu, X.; Ju, T.; Dawson, R.; Cao, J.; Xu, F.; Li, B. (2004). Use of sequential ASE extraction to evaluate the bioavailability of DDT and its metabolites to wheat roots in soils with various organic carbon contents. Sci. Total Environ, 320, pp. 1 - 9. https://doi.org/10.1016/S0048-9697(03)00452-2.
Tóth, E; Tölgyesi, A; Bálint, M; Ma, X; Sharma, V.K. (2022). Separation of fosetyl and phosphonic acid in food matrices with mixed-mode HPLC column coupled with tandem mass spectrometric detection and method application to other highly polar pesticides. Journal of Chromatography B, 1189. https://doi.org/10.1016/j.jchromb.2021.123083.
USEPA. (2000). Enviromental Protection Agency.Method 3550 C. Ultrasonic Extraction [Online]. Disponible en: https://www.epa.gov/sites/default/files/2015-12/documents/3550c.pdf. Consultado: 10 enero 2022.
Vagi, M.C.; Petsas, A.S.; Kostopoulou, M.N.; Karamanoli, M.K.; Lekkas T.D. (2007). Determination of organochlorine pesticides in marine sediments samples using ultrasonic solvent extraction followed by GC/ECD. Desalination, 210(1-3), pp. 146–156. https://doi.org/10.1016/j.desal.2006.06.020.
Artículos similares
- Francisco J. Jiménez G, Laia Posada, Cristina I. Castro H, Mariluz Betancur, José Adrian Rios Arango, Una Caracterización fisicoquímica y evaluación ambiental del jugo generado durante la extracción de la fibra de fique (Furcraea sp) , Revista EIA: Vol. 21 Núm. 42 (2024): Tabla de contenido Revista EIA No. 42
También puede {advancedSearchLink} para este artículo.

 PDF
PDF
 FLIP
FLIP







